II tüüpi neurofibromatoosi ravimid. II tüüpi neurofibromatoosi neurokirurgilised aspektid
2. tüüpi neurofibromatoos (NF2) on palju harvem kui NF1 neurofibromatoos, esinemissagedus 1: 33 000 kuni 1: 50 000. NF2 on pärilik autosomaalselt domineerival viisil, geeni penetrantsus on üle 95%. NF2 avaldub sageli elu teisel ja kolmandal aastakümnel. Kanteri jt andmetel on vestibulaarse schwannoma sümptomite ilmnemise keskmine vanus 20,4 aastat.
On vestibulaarsed schwannoomid moodustab umbes 8% intrakraniaalsetest kasvajatest ja umbes 80% nurgelistest tserebellopontiini kasvajatest. Enamik vestibulaarsetest skvanoomidest on juhuslikud ja ühepoolsed, avaldudes viiendal kümnendil.
Patsiendid, kellel on 2. tüüpi neurofibromatoos(NF2) ja kahepoolsed vestibulaarsed schwannoomid moodustavad 2 kuni 4% kõigist vestibulaarsete schwannoomide juhtudest.
2. tüüpi neurofibromatoos segi ajada sageli NF1-ga. Lõplik tõestus selle kohta, et NF1 ja NF2 on erinevad üksused, oli võimalik alles 1987. aastal. Paljud, sealhulgas Barkeri jt poolt läbi viidud molekulaarbioloogilised uuringud, on näidanud, et NF1 arengu eest vastutav geen paikneb 17. kromosoomi pika käe proksimaalse otsa lähedal. Rouelau jt samal perioodil läbi viidud sõltumatu uuring. näitas, et NF2 eest vastutav geen lokaliseerub 22. kromosoomis.
2. tüüpi neurofibromatoos areneb 22. kromosoomis asuva geenimutatsiooni pärimise tulemusena. Geenisiseste mutatsioonide esinemissagedus on hinnanguliselt 6,5 x 10-6. Nendel patsientidel puudub umbes 50% juhtudest perekonna ajalugu ja tekivad uued generatiivsed mutatsioonid. Pärast meningiomide tsütogeneetilisi uuringuid 1982. aastal tõusis NF2 tõenäolise allikana esile kromosoom 22. HF2 geen määrati hiljem kromosoomi 22 nii sidumise kui ka heterosügootsuse analüüsi andmete põhjal vastavalt 1986. ja 1987. aastal.
IN 1993 aasta kaks sõltumatut teadlaste rühma eraldasid NF2 geeni, mida nimetatakse merliiniks või schwannomiiniks. HF2 geen ulatub kromosoomis 22q12.2 üle 100 kb ja sisaldab 17 eksoni. Messenger RNA kodeeriv järjestus on 1785 bp pikk ja kodeerib 595 aminohappelist valku. Geeniprodukt on lähedane valkude perekonnale, mille hulka kuuluvad moesiin, ezriin, radiksiin, taliin ja teised, mis on osa valgu 4.1 alamperekonnast. Need valgud osalevad tsütoskeleti komponentide kleepumisel tsütoplasmaatilisele membraanile ja paiknevad aktiinirikastes mikrovillides. Arvatakse, et merliini valgu N-terminaalne piirkond interakteerub tsütoplasma membraani komponentidega ja C-terminaalne piirkond tsütoskeletiga.
Merlin või Schwannomine on valdavalt ekspresseeritud närvisüsteemi rakkudes ja läätses... Praegu arvatakse, et valgu merliini üleekspresseerimine võib pärssida rakkude kasvu ja see aitab kaasa rakkude pinnal olevate eendite moodustumisele ja rakkude pikenemisele. 1994. aastal on Tikoo jt. testis merlini kui kasvaja geeni supressori võimet. Järgnevalt, esitades NF2 valgu v-Ha-Ras-transformeeritud NIH 3T3 rakkudes, suutsid nad demonstreerida pahaloomulise fenotüübi elimineerimist ja kinnitada seeläbi merlini võimet kasvajat pärssida.
Kuigi täpne NF2 valgu funktsioonid pole täielikult mõistetavad, näitavad olemasolevad andmed, et see osaleb rakkudevahelises või rakumembraanisiseses vastastikmõjus ning mängib olulist rolli raku liikumises, vormis ja vastasmõjus. Merliini valgu funktsioonide kadumise tagajärjel võib täheldada kontakti pärssimise rikkumist, mis viib onkogeneesini.
Mutatsioonid, mis hõlmavad geen NF2 täheldatakse 22-59% -l sporaadilise vestibulaarse schwannoomaga patsientidest. Welling jt. võrdles geneetilise mutatsiooni tuvastamise sagedust sporaadilise vestibulaarse schwannoomaga ja NF2-ga patsientidel ning leidis olulise erinevuse vastavalt 66 ja 33%, märkides, et onkogeneesi ajal võivad tekkida erinevad mutatsioonimehhanismid. Praeguseks on tuvastatud üle 200 NF2 geeni mutatsiooni, sealhulgas ühe aluse asendused, insertsioonid ja deletsioonid. Enamik mutatsioone põhjustab valgu C-terminaalse otsa kärpimist; missense mutatsioonidest on tuvastatud ainult 13.
Defektid geen NF2 leidub teistes neoplasmades, sealhulgas meningioomides, pahaloomulistes mesotelioomides, melanoomides ja rinnavähis.
Uuring genotüübi-fenotüübi korrelatsioonid viitab sellele, et NF2 geeni mutatsioonid on seotud erineva fenotüübilise ekspressiooniga. Ruttledge jt. leidis, et valkude lõikamisest tulenevad mutatsioonid NF2 geenis on seotud NF2 raskemate kliiniliste ilmingutega (Wishart), samas kui missense ja splaissingu saidi mutatsioonid on seotud haiguse kergema progresseerumisega (Gardner).
Parry jt. viitas ka sellele, et võrkkesta kahjustused on seotud geenivalgu hävitavate mutatsioonidega. Mõlemas uuringus leiti fenotüübilises ekspressioonis perekonnasiseseid erinevusi.
Küll NF2 geenimutatsioonid mängivad vestibulaarsete schwannoomide olemuses juhtivat rolli, on võimalus, et vestibulaarsete schwannoomide arengule aitavad kaasa ka teised geneetilised lookused. Lisaks ülaltoodule tuleb märkida, et 2. tüüpi neurofibromatoosi (NF2) geeni mutatsioone leidub kõigil vestibulaarse schwannoomaga patsientidel, samas kui võimalikud on genotüübi-fenotüübi korrelatsioonid, mille olemasolu viitab sellele, et ka teised geneetilised lookused võivad aitavad kaasa vestibulaarsete schwannoomide esinemisele ja patsientide lõplikule fenotüübile.
Geenide tuvastamine, vastutab NF2 eest sõltub suuresti meie arusaamast patoloogiast molekulaarsel tasandil ja kliinilise heterogeensuse eest vastutavatest teguritest II tüüpi neurofibromatoosiga (NF2) patsientidel. Peagi saab merliini funktsioonide mõistmine kasvaja moodustumisel kasvajavastase ravi väljatöötamise aluseks, mis võib lõpuks leevendada 2. tüüpi neurofibromatoosiga (NF2) seotud patsientide kannatusi.
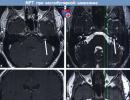
 Kontrastsuse suurendamisega MPT, režiim T1.
Kontrastsuse suurendamisega MPT, režiim T1. Intrakanalikulaarne vestibulaarne skwanoom vasakul (VS, nool) (a) aksiaalsetes ja (c) frontaalsetes sektsioonides.
Vestibulaarne skwanoom (VS) asub piirkonnas, kus CISS-järjestuses (b) suure eraldusvõimega T2-kaalutud tomogrammidel ei ole sisemise kuulmiskanali piirkonnas tserebrospinaalvedelikust (nool) signaali.
Kontrastsuseta režiimis T1 ei visualiseerita VS-i. d) Nool näitab kasvaja asukohta, mis pole nähtav.
II tüüpi (teine) neurofibromatoos (NF2)- pärilik või spontaanselt tekkiv autosoomne dominantne pärilik haigus, mida iseloomustab kesknärvisüsteemis ja perifeersetes närvides lokaliseeritud mitmete healoomuliste kasvajate, peamiselt švanoomide ja meningioomide, moodustumine. Hoolimata neoplasmide healoomulisest olemusest on see haigus aju funktsiooni kahjustavate intrakraniaalsete kasvajate moodustumise tõttu sageli surmav. Selle haiguse jaoks puudub meditsiiniline ravi, pealegi on patsiendid sunnitud kasvajate eemaldamiseks läbima mitu kirurgilist sekkumist, mis varem või hiljem põhjustab kurtust ja pimedaksjäämist. Haiguse areng on seotud geenikahjustustega NF2... Selle geeni mutatsioonid on seotud nii sporaadiliste schwannoomide ja meningiomide moodustumisega kogu kehas kui ka kasvajate arenguga, mis esmapilgul ei ole seotud neurofibromatoosiga, näiteks pahaloomuliste mesotelioomidega.
Epidemioloogia
II tüüpi neurofibromatoos esineb ühel 50 000-st vastsündinust.
Etioloogia
NF2 geen paikneb 22. kromosoomi (22q12) pikal õlavarrel ja kodeerib kasvaja kasvu pärssiva aine - valgu merliini või schwannomine - sünteesi. Merlini omadused ja struktuur on väga lähedased kolmele homoloogsele valgule - ezriinile, radiksiinile ja moesiinile (kust see ka oma nime sai) M oezin E zrin R adiksiin L nagu prote IN ). Kõik need valgud toimivad membraani organiseerijatena ja pakuvad peamiselt rakuskeleti (mikrotuubulite süsteem) ülesehitust ja toimimist. Need valgud on neuroektodermaalse päritoluga rakkude proliferatsiooni reguleerimisel kõige olulisemad.
Ühe merliini sünteesi kodeeriva NF2 geeni mutatsioon raku tasandil ei avaldu, kuna alleelgeen toodab RNA raku vajadustele piisava valgu sünteesiks. Kui see on kahjustatud (teise geneetilise sündmuse tagajärjel), peatub rakus normaalse merlini süntees, nihkub kasvu reguleerimise dünaamiline tasakaal proliferatsiooni suunas ja tekib kasvaja healoomuline kasv.
Kliiniline pilt
II tüüpi neurofibromatoosi korral tekkivad kasvajad on healoomulised, kuid võrreldes I tüüpi neurofibromatoosi neoplasmidega bioloogiliselt agressiivsemad. Seonduvate pahaloomuliste kasvajate tekkimise tõenäosus suureneb NF2-ga patsientidel ebaoluliselt.
Diagnostika
NF2 absoluutne diagnostiline kriteerium on VIII närvi kahepoolsed neuroomid. Samuti tuvastatakse NF2 diagnoos, kui määratakse patsiendil, kellel on selle haigusega otsene sugulane, kas VIII närvi ühepoolne neuroom või kahe või enama järgmise märgi kombinatsioon:
- neurofibroomid
- meningioomid (üks või mitu)
- glioomid (üks või mitu)
- schwannoomid, sealhulgas seljaaju (üks või mitu)
- juveniilse tagumise subkapsulaarse läätse katarakt või läätse hägusus
Café-au-lait'i laike täheldatakse umbes 80% -l NF2-ga patsientidest, kuid neil puudub diagnostiline väärtus.
Ravi
Kahepoolsete neuroomide ja säilinud kuulmisega on soovitatav alustada ravi väiksema kasvajaga, kuulmislanguse korral - parema kuulmiskõrva küljelt. Kui pärast kasvaja täielikku eemaldamist jääb sellel küljel kuulmine rahuldavaks, siis tuleks eemaldada teine kasvaja. Kui kuulmist ei õnnestunud säilitada, soovitatakse järelejäänud neuroomi korral oodata taktikat ja sümptomite suurenemise korral tuumori osalist eemaldamist (kõrge kurtuse riski tõttu).
Kui NF2-ga mitteseotud neuroomid ja neurofibroomid tõrjuvad ainult kuulmisnärvi, siis NF2 korral levib viinamarjahunnikute kujul kasvaja sageli 8. närvi kiudude vahel, mis raskendab nende patsientide kuulmist. Samuti on NF2-s raske kasvajat teistest kraniaalnärvidest eraldada, peamiselt näonärvist.
Teiste koljusiseste kasvajate juuresolekul on näidustatud nende kirurgiline eemaldamine, kui moodustumise lokaliseerimine ja suurus seda võimaldab, või radiokirurgiline ravi.
85.0II tüüpi (teine) neurofibromatoos (NF2)- pärilik haigus, mis soodustab kasvajate arengut inimestel.
Epidemioloogia
II tüüpi neurofibromatoos esineb ühel 50 000-st vastsündinust.
Etioloogia
NF2 geen paikneb 22. kromosoomi (22q12) pikal õlavarrel ja kodeerib kasvaja kasvu pärssiva aine - valgu merliini või schwannomine - sünteesi. Merlini omadused ja struktuur on väga lähedased kolmele homoloogsele valgule - ezriinile, radiksiinile ja moesiinile (kust see ka oma nime sai) M oezin E zrin R adiksiin L nagu prote IN ). Kõik need valgud toimivad membraani organiseerijatena ja pakuvad peamiselt rakuskeleti (mikrotuubulite süsteem) ehitust ja toimimist. Need valgud on neuroektodermaalse päritoluga rakkude proliferatsiooni reguleerimisel kõige olulisemad.
Ühe merliini sünteesi kodeeriva NF2 geeni mutatsioon raku tasandil ei avaldu, kuna alleelgeen toodab RNA raku vajadustele piisava valgu sünteesiks. Kui see on kahjustatud (teise geneetilise sündmuse tagajärjel), peatub rakus normaalse merlini süntees, nihkub kasvu reguleerimise dünaamiline tasakaal proliferatsiooni suunas ja tekib kasvaja healoomuline kasv.
Kliiniline pilt
II tüüpi neurofibromatoosi korral tekkivad kasvajad on healoomulised, kuid võrreldes I tüüpi neurofibromatoosi neoplasmidega bioloogiliselt agressiivsemad. Seonduvate pahaloomuliste kasvajate tekkimise tõenäosus suureneb NF2-ga patsientidel ebaoluliselt.
Diagnostika
NF2 absoluutne diagnostiline kriteerium on VIII närvi kahepoolsed neuroomid. Samuti tuvastatakse NF2 diagnoos, kui määratakse patsiendil, kellel on selle haigusega otsene sugulane, kas VIII närvi ühepoolne neuroom või kahe või enama järgmise märgi kombinatsioon:
- meningioomid (üks või mitu)
- glioomid (üks või mitu)
- schwannoomid, sealhulgas seljaaju (üks või mitu)
- juveniilse tagumise subkapsulaarse läätse katarakt või läätse hägusus
Café-au-lait'i laike täheldatakse umbes 80% -l NF2-ga patsientidest, kuid neil puudub diagnostiline väärtus.
Ravi
Kahepoolsete neuroomide ja säilinud kuulmisega on soovitatav alustada ravi väiksema kasvajaga, kuulmislanguse korral - parema kuulmiskõrva küljelt. Kui pärast kasvaja täielikku eemaldamist jääb sellel küljel kuulmine rahuldavaks, siis tuleks eemaldada teine kasvaja. Kui kuulmist ei õnnestunud säilitada, soovitatakse järelejäänud neuroomi korral oodata taktikat ja sümptomite suurenemise korral tuumori osalist eemaldamist (kõrge kurtuse riski tõttu).
Kui NF2-ga mitteseotud neuroomid ja neurofibroomid tõrjuvad ainult kuulmisnärvi, siis NF2 korral levib viinamarjahunnikute kujul kasvaja sageli 8. närvi kiudude vahel, mis raskendab nende patsientide kuulmist. Samuti on NF2-s raske kasvajat teistest kraniaalnärvidest eraldada, peamiselt näonärvist.
Teiste koljusiseste kasvajate juuresolekul on näidustatud nende kirurgiline eemaldamine, kui moodustumise lokaliseerimine ja suurus seda võimaldab, või radiokirurgiline ravi.
Neurofibromatoos on geneetiline häire, mida iseloomustab toiterakkude (Schwanni rakud) ebanormaalne kasv koos väiksemate ja suuremate kasvajate moodustumisega.
Kasvajad võivad olla healoomulised või pahaloomulised. Neurofibromatoos on suhteliselt haruldane haigus, mis mõjutab ühte 2500–4000 sündinud last. See on autosoomne dominantne pärilik haigus. Haigus esineb tavaliselt kahes põhivormis (1. ja 2. tüüp, vanemad nimed - perifeerne ja tsentraalne).
Enamasti mängib haiguse arengu põhjusena kaasasündinud mutatsioon, kuid see on võimalik ka haiguse arenguks uute mutatsioonide tekkimise tagajärjel. Diagnoosi saab geneetilise analüüsi abil täpselt kindlaks määrata.
Probleemi päritolu leidmine
Neurofibromatoos on pärilik autosoomne domineeriv häire. See tähendab, et teatud geenikombinatsiooniga on haigus vanematelt päritud. Autosomaalse domineeriva pärandi korral mõjutab haigus mõlemat sugu võrdselt sageli.
Haigust edastavad geenid, mis asuvad mitte-sugukromosoomidel - autosoomidel (kromosoom 17 on kõige tüüpilisem 1. tüüpi neurofibromatoosi korral, 22. tüüp 2. tüüp).
Teine, vähem levinud variant on uute mutatsioonide tekkimine. See tähendab, et haigus ilmneb inimestel esmakordselt uute mutatsioonide tekkimisega. Tema vanemad ega teised sugulased seda haigust ei põe, kuid inimene annab haiguse hiljem edasi oma järeltulijatele.
Haiguse sordid
Neurofibromatoos on jagatud kahte peamist tüüpi:
- Tüüp NF1 tuntud ka kui von Recklinghauseni tõbi. Kogu haigus esineb suhtega 1: 3000 inimest.
- Tüüp NF2 on haruldasem nähtus, mõjutab 1 inimest 25 000-st.
Samuti eristatakse veel 4 haigusetüüpi, kuid need on äärmiselt haruldased ja nende raviskeem ei erine teist tüüpi haiguste ravist.
Mõlemad tüübid moodustavad eraldi haigused, millel on erinevad põhjused ja sümptomid.

Sümptomid ja ilmingud
Mõlemat tüüpi haigused avalduvad erineval viisil ja kliinilise pildi olemus on erinev.
Von Recklinghauseni tõbi
Recklinghauseni neurofibromatoos avaldub lastel ja sellel on järgmised sümptomid:
- Valge kohvi iseloomulikud nahaplaastrid... Helepruunid laigud nahal on valutu. Laigud lapsepõlves kasvavad kuni 5 mm, noorukieas - nende suurus suureneb kuni 15 mm.
- Freckles seda tüüpi esinevad need ebatavalistes kohtades, näiteks nahavoltides.
- Healoomulised nahakasvajad - neurofibroomid... Need on healoomulised kasvajad, mis kasvavad naha all. Lapsepõlves on nad väikesed, vanuse kasvades reeglina suurenevad. Neurofibroomide arv on inimeseti erinev, mõnel juhul katavad need kasvajad kogu keha. Mõned neist põhjustavad pidevat sügelust, jäsemete kuju muutusi või talitlushäireid.
- Nägemisnärvi glioom... Glioma on nägemisnärvi healoomuline kasvaja, mis põhjustab nägemiskahjustust ja lastel põhjustab see värvitaju muutumist.
- Lisha sõlmed... Need on pruunid laigud silma iirises.
- Kõrge vererõhk.
- Perifeerse närvi ümbrise pahaloomulised kasvajad... Igal närvil on oma kest. Pahaloomulisuse kahtlus on olemas, kui neurofibroom ootamatult paisub, muutub valulikuks, ilmnevad nõrkus, meeleolu muutused ja jäsemete kipitus.

2. tüüpi neurofibromatoos
Esimesed seda tüüpi häired ilmnevad tavaliselt pärast 20. eluaastat, väikelastel ei põhjusta see haigus tavaliselt mingeid sümptomeid.
Iseloomulike sümptomite hulgas märgitakse järgmisi rikkumisi: 
- kuulmislangus, surin ja kõrvade kipitus;
- tasakaalu säilitamise probleemid;
- sageli esineb pearinglust ja oksendamist;
- kasvajate kasv kõrva piirkonnas, mis kahjustab kuulmist, ja aju signaale edastavate närvide tasakaal.
Mõnel inimesel kasvab see otse ajus, kuid ei avaldu alati; me räägime healoomulistest kasvajatest. Probleem tekib siis, kui kasvaja kasvab suureks ja surub ümbritsevat ajukudet alla. See võib avalduda peavaluna, pearinglusena, oksendamisena.
Need võivad ka areneda, mis võib põhjustada:
- seljavalu;
- lihasnõrkus;
- jäsemete kipitus, tuimus.
NF2 healoomulised kasvajad näevad välja nagu kõrgenenud nahk, mille läbimõõt on umbes 2 cm.
Haruldaste haigustüüpide ilmingud
Muud tüüpi neurofibromatoosi sümptomid:
- haigus 3 tüüpi mida iseloomustab mitmete naha neurofibroomide ilmnemine, mis võib põhjustada nägemisnärvi glioomi, neurolemma ja;
- 4 tüüpi haigus on segmentaalne ja mõjutab ainult ühte konkreetset nahapiirkonda;
- neurofibromatoos 5 tüüpi mida iseloomustab neurofibroomide puudumine ja see avaldub ainult tumedate laikude olemasolul;
- 6 tüüp haigust iseloomustab välimus (nagu 2. tüüpi neurofibromatoosi korral) pärast 20. eluaastat. Ilmuvad neurofimid; haigus omandatakse kõige sagedamini.

Diagnostilised kriteeriumid ja geneetiline analüüs
Neurofibromatoosi diagnoosimisel on oluline teada, et räägime pärilikust haigusest, millel on erinevad ilmingud. Selle teabe põhjal on nn. diagnostilised kriteeriumid, mille eesmärk on aidata seda haigust "avalikustada".
Kriteeriumiloendis on esimesed kohvik-au-lait-laigud (“valge kohv”), mille puhul 6 või enama tükikese arv on märgitud suurusega 5 millimeetrit või rohkem. Teine omadus viitab 2 või enama neurofibroomi, mitmekordsete frecklite esinemisele nahavoltides (kaenlaalustes ja kubemes) ja nägemisnärvi glioomides.
Diagnoosimisel mängib olulist rolli ka kahe või enama Leeschi laigu olemasolu ja luu düsplaasia. Ja lõpuks, haiguse sagedus perekonnas pole vähem tähtis, eriti vanemate, vendade ja õdede suhtes. Ülaltoodud tunnuste esinemissagedus suureneb patsiendi vanusega.
 Kõige sagedamini on neurofibromatoosi võimalik diagnoosida lapsepõlves, kuni 4-aastaselt. Tavaliselt põhineb diagnoos tüüpilisel kliinilisel pildil, kuid kahtluste või ebakindluse korral võite kasutada geneetika abi. Sellisel juhul saab haiguse tuvastamiseks kasutada DNA või RNA analüüsi.
Kõige sagedamini on neurofibromatoosi võimalik diagnoosida lapsepõlves, kuni 4-aastaselt. Tavaliselt põhineb diagnoos tüüpilisel kliinilisel pildil, kuid kahtluste või ebakindluse korral võite kasutada geneetika abi. Sellisel juhul saab haiguse tuvastamiseks kasutada DNA või RNA analüüsi.
Selle uuringu jaoks on piisav perifeerse venoosse vere kogumine. Kui haigus esineb ühel tulevasest vanemast, on võimalik sünnieelne geneetiline testimine, mida tehakse sageli amniotsenteesiga. Lisaks saate enne implantatsiooni uurida munarakke või spermat, vahetult enne lapse viljastamist ja viljastumist.
Lastehaigus
Lastel võib tekkida 3 erinevat tüüpi neurofibromatoosi. Igaüks neist areneb geenides esineva või kohe pärast viljastumist tekkinud geneetilise defekti tõttu.
1. tüüpi neurofibromatoosi geen on 17. kromosoomis ja suurendab valgu neurofibromiini tootmist. See valk aitab kontrollida rakkude kasvu närvisüsteemis. NF1 geeni mutatsioon põhjustab valgu kadu ja rakud kasvavad ebanormaalselt.
NF2 geen esineb 22. kromosoomis ja mõjutab Merlini valgu tootmist. NF2 mutatsioon viib valgu kadumiseni, mille tagajärjel jõuab see närvisüsteemi rakkude kontrollimatu kasvuni.
SMARCB1 geen esineb 22. kromosoomis ja see on schwannomatoosi põhjus.
Lastehaiguste kliiniku tunnused
Igal neurofibromatoosi tüübil on erinevad tunnused ja sümptomid.
Esimest tüüpi haigus avaldub kõige sagedamini lapsel. Laste 1. tüüpi neurofibromatoosi nähtavate sümptomite hulka kuuluvad:

Neurofibromatoos 2 (NF2) mõjutab peamiselt lapse kõrvu:
- järkjärguline kuulmislangus;
- tinnitus;
- tasakaalutus.
Mõnel harval juhul võib NF2 mõjutada ka seljaaju ja perifeerseid närve. Sümptomid on antud juhul järgmised:
- tugev valu;
- käte või jalgade tuimus või nõrkus.
Schwannomatosis on haruldane neurofibromatoosi vorm, mida väikelastel esineb harva. See haiguse variant areneb tavaliselt vanemas eas ja põhjustab selgroo, kolju- või perifeersete närvide kasvajaid.
Selle haigusvormi esinemisel võib tekkida krooniline valu mis tahes kehaosas.
Kuidas saab inimest aidata?
Neurofibromatoos on geneetiline haigus ja kahjuks ravimatu. Kasvaja moodustumine toimub DNA kaasasündinud muutuste põhjal ja tänapäeval pole seda protsessi kuidagi võimalik mõjutada.
Narkootikumide ravi hõlmab järgmiste ravimite võtmist:
- Ketotifeen;
- Fenkarol;
- Tigazon rakkude jagunemise kiiruse vähendamiseks;
 Kasvaja korral, mis häirib patsienti (neoplasmi piirkonnas on sissetungimise tõttu tervesse koesse surve, seedetrakt sulgub või kasvaja on inimese jaoks kosmeetiliselt ebameeldiv), saab selle kirurgiliselt eemaldada . Tavaliselt üritab kirurg kogu kasvaja eemaldada. Kuid pole mingit garantiid, et see mujal ei ilmu.
Kasvaja korral, mis häirib patsienti (neoplasmi piirkonnas on sissetungimise tõttu tervesse koesse surve, seedetrakt sulgub või kasvaja on inimese jaoks kosmeetiliselt ebameeldiv), saab selle kirurgiliselt eemaldada . Tavaliselt üritab kirurg kogu kasvaja eemaldada. Kuid pole mingit garantiid, et see mujal ei ilmu.
Ajukasvajad on problemaatilised, mis võivad suruda olulisi ajupiirkondi ja põhjustada hävitavaid nägemise, kuulmise, motoorse süsteemi komplikatsioone ning vallandada halvatuse või peavalu.
Pea piirkonnas saate lisaks avatud kirurgilisele sekkumisele kolju avamise ja kasvaja eemaldamise abil valida ka gamm noa võimaluse, mis toimib neoplasmale kiirgusega. Kui healoomulised kasvajad arenevad pahaloomulisteks metastaasideks, võib soovitada kemoteraapiat, kiiritusravi ja muid onkoloogias kasutatavaid meetodeid.
Kiiritusravi on tavaliselt välistatud sekundaarse pahaloomulise kasvaja esinemise tõttu (pärast kiiritust uue kasvaja tekkimine). Ravi eesmärk on haiguse varajane avastamine patsiendi tervisekontrolli, regulaarse kontrolli ja vajadusel kiire raviga.
Keemiaravi on tavaliselt esimene valik pärast kirurgilist eemaldamist. Luu deformatsiooni saab reguleerida kirurgilise tugevdamise või kosmeetilise korrigeerimisega.
Kõik ülaltoodud ravimeetodid aitavad parandada ainult elukvaliteeti, leevendada valu või vaimset stressi, kuid ei ravi seda haigust täielikult.
Neurofibromatoosi raviks rahvapäraste ravimitega soovitavad tervendajad võtta taruvaigu tinktuuri (100 g taruvaiku 500 ml alkoholi kohta). Seda infundeeritakse nädala jooksul pimedas kohas, pärast mida tuleks see filtreerida. Võtke 30 tilka päevas 3 korda. Hoidke tinktuuri toatemperatuuril pimedas kohas.
Miks on haigus ohtlik?
Neurofibromatoosiga, eriti esimest tüüpi, elamine on väga stressirohke ja tülikas, kuna see haigus on  hävitav mõju välimusele. Haigusel on negatiivne psühholoogiline mõju, isegi kui see on vaid naha välimuse väike moonutamine.
hävitav mõju välimusele. Haigusel on negatiivne psühholoogiline mõju, isegi kui see on vaid naha välimuse väike moonutamine.
See kehtib eriti noorukite kohta, kes on oma välimuse suhtes väga tundlikud, haiguse ilmingud põhjustavad häbitunnet ning põhjustavad depressiooni ja ärevust.
Lisaks võivad tüsistused olla tõsisemad: kasvajakoe hakkab väga kiiresti kasvama ja selle rakud levivad teistesse kehaosadesse (metastaasid).
Kuidas mitte silmitsi seista ohtliku haigusega?
Neurofibromatoosi ennetavad meetmed on keeruline küsimus, mis hõlmab mitmeid võimalusi. Kaasasündinud häire korral pole teada sajaprotsendilist viisi selle arengu takistamiseks.
Kui perekonnas on esinenud neurofibromatoosi, siis last planeeriva paari jaoks on võimalus geneetiliselt analüüsida. On vaja luua sugupuu ja märkida kõik juba haiged isikud.
Samuti on hea teada, millist tüüpi haigusest räägime sündimata lapse uuringute sünnieelse geneetilise diagnostika raames. Preimplantatsiooni geneetiline testimine võimaldab embrüot uurida enne emakasse implanteerimist.
Kui räägime elu jooksul omandatud haigusest, on teoreetiliselt võimalik vältida kõike, mis võib inimese geneetikat mõjutada (kiirgus, keemilised ja toksilised ained jne), kuid kahjuks ilma edu garantiita.
Ülaltoodud haiguste ennetamise võimalused võivad tunduda millegi üleloomulikuna, kuid vaatamata sellele on need mõnevõrra piiratud ega suuda alati haiguse arengut 100% võrra takistada.
(NF) on pärilik haigus, mis soodustab kasvajate arengut inimestel.
Kirjanduses kirjeldas neurofibromatoosi esmakordselt 1822. aastal Šoti kirurg Wishart, kes kirjeldas 2. tüüpi NF-ga patsienti. Esimese tüübi neurofibromatoosi uuris ja kirjeldas 1882. aastal Virchowi õpilane von Recklinghausen. Kuid 1916. aastal ühendas Cushing oma teadustöös need haigused üldnimetuse "Recklinghauseni tõbi" all ja alles pärast molekulaargeneetilisi uuringuid, mille tulemused avaldati aastatel 1985 ja 1987, olid põhimõttelised erinevused NF1 ja NF2 patogeneesis selgus. On tõestatud, et need on täiesti erinevad haigused, mis vajavad diferentseeritud kliinilist lähenemist.
Kirjanduses kirjeldatakse ainult kaheksa neurofibromatoosi "tüüpi", kuid viimasel ajal peetakse enamikku neist (välja arvatud NF2) NF1 abordivormideks ja neid ei eristata iseseisvate nosoloogiliste vormidena. Erandid võivad olla segmentaalne neurofibromatoos (NF5), kui NF1 tüüpilised ilmingud on lokaliseeritud ühes või enamas külgnevas dermatoomis (äärmiselt haruldased, tavaliselt mitte pärilikud), ja kui kaheksa hulka ei kuulu, siis selgroo neurofibromatoos, kus kõik seljaaju juured on sümmeetriliselt mõjutatud (kirjeldas ainult mõnda tähelepanekut).
1. tüüpi neurofibromatoos (NF1) on autosoomne dominantne häire (esinemissagedus populatsioonis on 1 3500 vastsündinust). Kõigil NF1 juhtudel lokaliseerub geneetiline defekt 17. kromosoomi tsoonis 11.2 (17q11.2). Siin paiknev geen NF1 kodeerib suure valgu - neurofibromiini - sünteesi, mis on seotud promootorvalkude (ras-valk ja selle analoogid) inaktiveerimisega, pakkudes rakkude kasvu dünaamilist kontrolli. NF1 geen on üks peamisi kasvaja supresseerivaid geene umbes 30% kehakudedest, peamiselt neuroektodermaalse päritoluga. Kui NF1 geen on kahjustatud paari 17 ühes kromosoomis, muutub 50% sünteesitud neurofibromiinist defektne ja täheldatakse rakkude kasvu tasakaalu muutust proliferatsiooni suunas.
Tahaksime keskenduda II tüüpi neurofibromatoosile, mida varem nimetati "tsentraalseks neurofibromatoosiks" ja mis soodustab healoomuliste kasvajate ilmnemist kesknärvisüsteemis.
2. tüüpi neurofibromatoos (NF2), nagu ka NF1, on autosoomne domineeriv haigus, kuid seda esineb populatsioonis palju harvemini (1 juhtum 40 000 vastsündinu kohta). Selle haiguse geneetiline defekt on põhimõtteliselt erinevas kromosoomis ja seetõttu on selle haiguse patogenees erinev.
NF2 geen lokaliseerub kromosoomis 22 (22q12) ja kodeerib teise kasvaja kasvu pärssiva aine, valgu merliini sünteesi, mis toimib membraani organiseerijana ja tagab peamiselt rakukonna ehituse ja toimimise. See valk on kõige olulisem neuroektodermaalse päritoluga rakkude proliferatsiooni reguleerimisel.
Merlini sünteesi kodeeriva NF2 geeni mutatsioon ühes kromosoomis ei avaldu rakutasandil, sest merliini sünteesi 50% vähenemist tasandavad ERM valgud, mis on seotud ka rakkude proliferatsiooni reguleerimisega. Kui aga HF2 alleelgeen on kahjustatud ("teise geneetilise sündmuse" - sümmeetrilise mutatsiooni või heterosügootsuse kadumise tagajärjel 22. kromosoomis) tagajärjel normaalse merlini süntees rakus peatub, nihkub kasvu reguleerimise dünaamiline tasakaal toimub proliferatsioon ja kasvaja healoomuline kasv.
Arvestades paljude mittespetsiifiliste sümptomite esinemist patsientidel, töötas USA riiklik tervishoiuinstituut 1987. aastal "NF2" diagnoosimiseks välja absoluutsed diagnostilised kriteeriumid (NIH kriteeriumid) ja lisas neile hiljem tõenäolised kriteeriumid (tabel 1).
Tabel 1. 2. tüüpi neurofibromatoosi diagnostilised kriteeriumid (sisaldab NIH kriteeriume ja tõenäolisi kriteeriume).
Absoluutsed märgid | Tõenäolised märgid |
||
Kahepoolsed vestibulaarsed skvanoomid (VIII kraniaalnärvi neurinoom) | Perekonna ajalugu | Ühepoolne vestibulaarne skwanoom Vanus alla 30 aasta Igaüks neist kahest (meningioma, glioom, neurofibroom, schwannoma, tagumine subkapsulaarne läätse katarakt) | Mitu meningioomi (kaks või enam) Ühepoolne vestibulaarne skwanoom Kaks või enam neist kasvajatest (glioom, neurofibroom, schwannoma) või Katarakt |
Antinheimo jt andmetel on 3% schwannoomaga ja 1% meningioomiga patsientidest neurofibromatoos 2. NF2 on 20% -l hulgim meningioomiga patsientidest [2].
Haiguse kliiniline ilming.
2. tüüpi neurofibromatoosi kõige tavalisem manifestatsioon on kahepoolsete vestibulaarsete schwanoomide olemasolu. Teiseks levinumaks kasvajaks on teiste kolju-, selja- ja perifeersete närvide skvanoomid. Palju harvemini (vähem kui 10%) on meningioomid (intrakraniaalsed, sealhulgas nägemisnärvide ja seljaaju meningioomid), epindümoomid ja glioomid.
Põhimõtteliselt võivad schwanoomid tekkida kõikjal kehas, kus on Schwanni rakkudega närve. Kasvajate eelistatud lokaliseerimine NF2 VIII närvil on tänaseni seletamatu.
Kõige sagedamini pöörduvad patsiendid arsti juurde seoses kuulmislanguse või tinnituse ilmnemisega, mis on haiguse alguses ühepoolsed. Nende kaebustega võivad kaasneda pearinglus ja ataksia. Nendel patsientidel tuvastatakse 20-30% -l juhtudest lisaks vestibulaarsetele schwannoomadele meningioomid, seljaaju või perifeersed kasvajad.
Sageli avaldub haigus Belli halvatusega (3-5%), mis ei allu ravile ja möödub mitu aastat, enne kui selle väljanägemise põhjus tuvastatakse. Mõnel patsiendil tekib poliomüeliiditaoline sündroom (umbes 3%).
60-80% II tüüpi neurofibromatoosiga patsientidest on nägemishäired - katarakt, retinoblastoomid, hemartroomid, nägemisnärvide meningioomid jne.
Ligikaudu 70% -l patsientidest on muutused nahas ja perifeersete närvide distaalsetes harudes (kohvi- ja piimalaigud, švanoomid, neurofibroomid)
2. tüüpi neurofibromatoosiga meningioomid paiknevad sagedamini supratentoriaalselt ja paiknevad peamiselt falciformi protsessil frontaalses ja parietaalses piirkonnas. Kindlat tüüpi meningioma esinemise regulaarsust ei ole tuvastatud. Iseloomulik on ka seljaaju meningioomide olemasolu. Meningioma histoloogilise tüübi ja NF2 olemasolu vahel korrelatsiooni ei leitud.
NF2 ja meningiomide sagedast kombinatsiooni seletatakse geneetilise defekti olemasoluga ühes kromosoomis. Sporaadiliste meningioomide korral esinevad 22. kromosoomi NF2 geeni mutatsioonid 30–60% -l.
Kirjeldatud on meningioma ja schwannoma rakkudest koosnevaid segakasvajaid. Reeglina on need kasvajad lokaliseeritud väikeaju nurga piirkonnas. Samuti tuvastatakse NF2 korral sageli meningoangiomatoos.
8% juhtudest on meningioomid esimesed kasvajad enne VIII kraniaalnärvi neuroomi ilmnemist. Meningiomaga patsientide geneetiline uurimine näitab sageli (90% juhtudest) 22. kromosoomi mutatsiooni.
NF2 madala astme epindümoomid ja glioomid on palju vähem levinud ning kasvajad lokaliseeruvad peamiselt ajutüves ja seljaaju ülemistes emakakaela segmentides. Nende kasvajate pahaloomuline kasvaja on haruldane ja enamasti on see seotud kiiritusraviga.
Kirurgiline taktika.
Kahepoolsete neuroomide ja säilinud kuulmisega on soovitatav alustada ravi väiksema kasvajaga, kuulmislanguse korral - parema kuulmiskõrva küljelt. Kui pärast kasvaja täielikku eemaldamist jääb sellel küljel kuulmine rahuldavaks, siis tuleks eemaldada teine kasvaja. Kui kuulmist ei õnnestunud säilitada, soovitatakse järelejäänud neuroomi korral oodata taktikat ja sümptomite suurenemise korral tuumori osalist eemaldamist (kõrge kurtuse riski tõttu).
Kui NF2-ga mitteseotud neuroomid ja neurofibroomid tõrjuvad ainult kuulmisnärvi, siis NF2 korral levib viinamarjahunnikute kujul kasvaja sageli 8. närvi kiudude vahel, mis raskendab nende patsientide kuulmist. Samuti on NF2-s raske kasvajat teistest kraniaalnärvidest eraldada, peamiselt näonärvist.
Teiste koljusiseste kasvajate juuresolekul on näidustatud nende kirurgiline eemaldamine, kui moodustumise lokaliseerimine ja suurus seda võimaldab, või radiokirurgiline ravi.
JUHTUMID TAVAST
Siin on kirjeldatud NF2 ning mitme koljusisese ja ekstrakraniaalse massiga patsiendi edukat ravi.
Patsient L., 27-aastane, hospitaliseeriti Venemaa meditsiiniteaduste akadeemia vabariikliku keemiakeskuse riigiasutuse neurokirurgiaosakonnas. BV Petrovsky 29.03.2006 kaebas peavalu, mis süveneb hommikul ja ettepoole painutades, eksoftalm paremal, parema silma valu, nägemise halvenemine, topeltnägemine, parema ninapoole korduv "ülekoormatus".
Anamneesi põhjal on teada, et umbes 6 kuud tagasi avastas patsient paremalt väikese eksoftalmi, mille kohta teda kontrollisid ja ravisid silmaarstid elukohas, kuid eksoftalm suurenes. 2-3 kuu pärast ilmnes frontaalses piirkonnas ja orbiidil paiknev peavalu, mida MSPVA-de tarbimine ei leevendanud. Järk-järgult suurenes peavalu, perioodiliselt, ilma põhjuseta, hakkasid ilmnema raskused paremal nina hingamisel. Ambulatoorselt tehti aju CT, mis näitas frontaalse piirkonna basaalosades olevat massi, mis levis läbi etmoidlabürindi ninaõõnde ja kasvas läbi mediaalseina parema orbiidi õõnsusse. Perekonna ajalugu pole koormatud, patsiendi sugulaste seas pole seni ühtegi onkoloogilist haigust tuvastatud.
Patsiendi üldine seisund vastuvõtmisel on rahuldav. Patsiendi somaatilises seisundis patoloogiat ei ilmnenud.
Neuroloogiline seisund: teadvus on selge, orienteeritud, adekvaatne. GCS - 15 punkti. Ajukelme sümptomeid pole. Parempoolne eksoftalm, õpilaste OS = OD, fotoreaktsioon ja sarvkesta refleksid on erksad. Parema silmamuna ülespoole ja mediaalselt liikumise piiramine, parempoolse lähenemise nõrgenemine, diploopia. Visus OD = 0,7, OS = 1. Nägu on sümmeetriline, keel on keskjoonel. Jäsemete kõõluse refleksid on vasakul mõnevõrra taaselustatud, lihastoonus külgede erinevusteta. Puuduvad pareesid ega sensoorsed häired. Teeb tahtlikult koordineerimiskatseid.
Patsiendi uurimisel pööratakse tähelepanu parempoolsele eksoftalmile, vasaku silmamuna liigutused on valulikud, paremal on need ülespoole ja mediaalselt mõnevõrra piiratud. Nina külgseinal, ülaosas, parempoolse silmakoopa lähedal, naha all, on tuntav ühtlase siledate servadega tiheda konsistentsi moodustumine. Parema käe peopesa pinnal on ümardatud nahaalune moodustis, mõõtmetega 0,7 x 0,5 x 0,5 cm, mis pole nahaga nihkunud ja palpeerimisel mõõdukalt valus. Samad nahaalused moodustised leiti vasaku käe teise sõrme keskmisest falangist ja kuklaluu piirkonnast.
Silmapõhjal ei leitud patoloogiat.
Patsienti vaatas otolarüngoloog läbi - parema ninakäigu külgseinal, tagumistes-ülemistes sektsioonides leiti tihe submukoosne moodustis, mis ulatub ninaõõnde õõnsusse 4-5 mm.
Patsiendile tehti kontrastselt aju MRI, mis näitas:
Etmoidluu projektsioonis ilmneb muutunud MR-signaali ebahomogeenne tsoon (hüpointense T1-kaalutud piltidel ja hüperintensiivne T2-kaalutud piltidel) kogumõõduga 77 x 35 x 39 mm, ebakorrapärase kujuga ja levinud parem orbiit (sise- ja ülemiste kaldus silmalihaste kokkusurumise ja nihkumisega silmamuna väljapoole ja väljapoole) ja paremal asuv ülemine ninakäik (luustruktuuride hävimisega) parempoolsetesse eesmistesse nina- ja pehmetesse kudedesse pool ninast. Laienedes koljuõõnde ekstraduraalselt, surub ja nihutab moodustis otsmikusagaraid tagant ja külgsuunas. Kahjustuse koljusisese osa MR-signaal suureneb järsult T1 ja T2 kaalutud piltidel.
Interhemisfääri sulcuse frontaalsetes osades määratakse T1 ja T2 piltidel ümmargune struktuur, millel on selged ühtlased kontuurid ja mis pärineb aju poolkuu, isointense. Formatsiooni suurus on umbes 8 mm.
Kraniovertebraalse ristmiku tasemel, selgrookanali sees vasakul ja piklikaju taga, tihedalt sellega külgnevalt, määratakse ümmargune selge ühtlaste kontuuridega mahumass, mis on T1 ja T2 kaalutud piltidel isointensiivne mõõtmetega suurusega 6 x 10 mm.
Pärast kontrastaine kasutuselevõttu täheldatakse selle intensiivset heterogeenset hariduse kogunemist nina ja ninakõrvalkoobaste piirkonnas. Teised koosseisud kogunevad kontrasti ühtlaselt. Spetsialistid peavad MRI andmeid polüpoosiks (?), Mida komplitseerib sekundaarne mükoosne infektsioon ja verejooks.
Pärast täiendavat uuringut, 6. aprillil 2006, tehti patsiendile operatsioon - osteoplastiline trepanatsioon frontaalses piirkonnas, väikese kumeruse meningioma eemaldamine paremas frontaalses piirkonnas (operatsiooni käigus tuvastatud), meningioma eemaldamine falx, kraniofatsiaalse massi moodustumise eemaldamine.
Üldanesteesia korral paigaldatakse nimmepiirkonna drenaaž L 3-L 4 intervalli ja äravoolu kaudu voolab läbipaistev, värvitu tserebrospinaalvedelik. Otsmikupiirkonna pehmetesse kudedesse tehti kaarjas sisselõige. Osteoplastiline trepanatsioon tehti frontaalses piirkonnas, täiendava resektsiooniga otsmikuluu ja frontaalse siinuse seintel kolju eesmise lohu põhja. Dura mater on pinges, koljuosa eesmise lohu põhjas leiti ekstraduraalselt lebav mahuline kahjustus. Paremas frontaalses piirkonnas dura materi ülaosas avati kaar ja leiti väike kumerav meningioma, mis eemaldati dura materi resektsiooniga selle esialgse kasvu kohas. 1,5 cm sügavusel asuva falsi eesmise kolmandiku meningioomile lähenemiseks kasutati interhemisfäärilist lähenemist. Meningioma eemaldati falksi resektsiooniga selle kasvu kohas. Dura mater defekt plastifitseeriti aponeuroosiga.
Eesmise kraniaalse lohu põhjas asuv kasvaja isoleeriti piki perifeeriat; kasvaja esialgse kasvu koht oli haistmisfossa põranda dura mater. Selles kohas eemaldati dura mater, misjärel eemaldati kasvaja intrakraniaalne osa, mis oli tahke komponent ja tihedate seintega tsüst. Eesmiste siinuste õõnsus täideti kasvaja tahke komponendiga, mis eemaldati, eemaldati ka otsmikupõletikest pärit limaskest. Edasi viidi läbi etmoidluu horisontaalse plaadi resektsioon, kasvaja poolt idandatud etmoidlabürindi resektsioon. Kasvaja intranasaalne osa eemaldati koljuõõnde kloppimisega ja pärast kasvaja eemaldamist moodustati koljuõõnde otsene läbipääs ülemise konja tasemel. Sellest lähenemisest eemaldati ka kasvaja intraorbitaalne osa. Hemostaas vererõhul 150/90 mm Hg
Dura mater defekt plastiseeriti kahe aponeuroosi kihiga, liimides mööda klapi perifeeriat fibriiniliimiga Tissukol-Kit. Operatsiooni lõpuks vajub aju ja pulseerib hästi. Moodustatud õõnsuse seinad on vooderdatud hemostaatilise marli "Surgecel" abil. Luu klapp kinnitati titaanplaatidega, kolju luu defekti esmane plastiline operatsioon tehti titaanimplantaadiga. Kihthaaval haava sulgemine. Jood, alkohol, ac. sidemega. Tehti nina eesmine tamponaad.
Eemaldatud neoplasmade histoloogilisel uurimisel avastati meningotelioomilise meningioma rakud.
Operatsioonijärgsel perioodil läbis patsient osakonnas konservatiivse ravi, sealhulgas vaskulaarsed, antibakteriaalsed ja põletikuvastased ravimid. 12 päeva jooksul oli patsiendil nimmepiirkonna äravool, mis seejärel eemaldati. Operatsioonijärgne haav paranes peamiselt. Tserebrospinaalvedelik ei leki ninast, näol puudub kosmeetiline defekt.
05.02.2006 tehti patsiendile kirurgilise ravi teine etapp - kuklaluuskaalude resektsioon, atlase tagumise poolkaare resektsioon, kraniovertebraalse lokaliseerimise mahulise moodustumise eemaldamine, kolju luu primaarne plastika. defekt titaanimplantaadiga. Schwannoomide eemaldamine parema käe peopesa pinnalt ja kuklaluu piirkonna pehmetest kudedest.
Üldanesteesia korral tehti pehmete kudede lineaarne sisselõige emakakaela-kuklaluu piirkonda, lähenedes vasakule küljele. Kuklaluu skaalad, atlase kaar, spinaalne protsess ja teise kaelalüli kaar luustati. Resekteeriti kuklaluu (rohkem vasakul) ja tagumise poolkaare kaalud. Ajukanal avati lineaarselt, suur kuklaserv, avati tserebrospinaalvedelik, mille järel aju sulatati. Pärast dura mater'i avamist vasakpoolse pagasiruumi kaudaalse osa ja seljaaju ülemiste segmentide tasemel on ümmargune halli värvi, tiheda konsistentsiga mahumass mass, mis on külgnevast ajust hästi eraldatud, pigistades ja nihutades see oli leitud. Ajutüvest ulatuvad väikesed arterid külgnevad tihedalt kasvaja mediaalsete osadega. Mikroskoobi all on arterid kasvajast tuimalt eraldatud, osaliselt hüübinud. Kasvaja kasvas lisanärvi kahest närvijuurest. Närvijuured hüübivad ja lõigatakse kasvajast ära, mille järel kasvaja eemaldatakse. Eemaldatud kasvaja suurus on 2 x 1 x 1 cm, hemostaas BP juures 110/70 mm Hg. Dura mater õmmeldi tihedalt katkenud õmblustega. Kihthaaval haava sulgemine.
Histoloogiline järeldus on schwannoma.
Samuti viidi läbi perifeersete masside eemaldamine, mis osutus samuti schwanoomideks.
16. mail 2006 vabastati patsient elukohajärgsete spetsialistide järelevalve all rahuldavas seisundis ilma neuroloogiliste defitsiitide ja kosmeetiliste defektideta.
Patsiendi uuringu, MRI andmete, histoloogiliste uuringute andmete põhjal, võttes arvesse neurofibromatoosi 2 absoluutseid ja tõenäolisi tunnuseid, diagnoositi patsiendil koos geneetikuga II tüübi neurofibromatoos, kranioofatsiaalne meningioma, mis levis itrakraniaalselt - frontaalsesse piirkond, ekstrakraniaalne - parema orbiidi ja ninaõõnde. Falksi eesmise kolmandiku meningioom. Kumeraalne meningioom paremas parietaalses piirkonnas. Vasaku aksessuaari (XI) närvi Schwannoma. Perifeersete närvide distaalsete harude schwannoomid (3). Kuklaluu piirkonna pehmete kudede schwannoma.
Aju kontroll-MRI 6 kuud hiljem ei näidanud koljuõõnes ühtegi massi. Emakakaela lülisamba MRI ei näidanud patoloogiat.
Piibelgraafika.
- Konovalov A. N., Kozlov A. V. Pärilikud haigused, mis aitavad kaasa koljualuse kasvajate arengule. Raamatus "Kolju aluse kasvajate kirurgia", lk 169-170.
- Antinheimo J, Haapasalo H, Haltia M, Tatagiba M, Thomas S, Brandis A, Sainio M, Carpen O, Samii M, Jaaskelainen J. Proliferatsioonipotentsiaal ja histoloogilised tunnused neurofibromatoosi 2-ga seotud ja juhuslikud meningioomid. J Neurosurg 1997; 87: 610-614.
- Antinheimo J, Sankila R, Carpen O, Pukkala E, Sainio M, Jaaskelainen J. Sporaadiliste ja NF2-ga seotud meningioomide ja švanoomide populatsioonipõhine analüüs. J Neurol 2000; 54: 71-76.
- Baser M, Mautner VF, Thakkar SD, Kluwe L. Neurofibromatoosi looduslugu 2. Am J Hum Genet 199; 63 (suppl 4): A63.
- Baser ME, Evans DGR, Jackler RK, Sujansky E, Rubenstein A. Pahaloomulised perifeerse närvi ümbrise kasvajad, kiiritusravi ja neurofibromatoos 2. Br J Cancer 200; 82: 998.
- Baser ME, Friedman JM, Evansi peadirektoraat. Ellujäämise ennustajad neurofibromatoosis 2. Am J Hum Genet 199; 65 (suppl 4): A61.
- Baser ME, Mautner VF, Ragge NK, Nechiporuk A, Riccardi VM, Klein J, Sainz J, Pulst SM. Neurofibromatoosi 2 sümptomaatiline diagnoosimine seotud geneetiliste markerite, neurokujutise ja silmauuringute abil. Neurology 1996; 47: 1269-1277.
- Must peaminister. Meningioomid. Neurokirurgia. 1993 aprill; 32 (4): 643-57.
- Tšakrabarty A, Franks AJ. Meningioangiomatoos: juhtumi aruanne ja kirjanduse ülevaade. Br J Neurosurg. 1999 aprill; 13 (2): 167–73.
- Claus EB, Bondy ML, Schildkraut JM, Wiemels JL, Wrensch M, Must PM. Koljusisese meningioma epidemioloogia. Neurokirurgia. 2005 detsember; 57 (6): 1088-95
- Crowe FW, Schull WJ, Neal JV. Mitme neurofibromatoosi kliiniline patoloogiline ja geneetiline uuring. Springfield, Illinois: Charles C Thomas, 1956.
- Elizabeth J, Menon G, Nair S, Radhakrishnan VV. Schwannoma ja meningioma segakasvaja neurofibromatoos-2 patsiendil: haigusjuht. Neurol India 2001; 49: 398-400
- Eljamel MS, Foy peaminister. Mitu meningioma ja nende seos neurofibromatoosiga. Kirjanduse ülevaade ja seitsme juhtumi aruanne. Surg Neurol. 1989 august; 32 (2): 131-6.
- Evans DGR, Birch JM, Ramsden R. II tüüpi neurofibromatoosi laste esitus. Arch Dis Child 1998; 81: 496-499.
- Evans DGR, Huson SM, Donnai D, Neary W, Blair V, Newton V, Harris R. 2. tüüpi neurofibromatoosi kliiniline uuring. QJ Med 1992; 84: 603-618.
- Evans DGR, Huson SM, Donnai D, Neary W, Blair V, Newton V, Strachan T, Harris R. 2. tüüpi neurofibromatoosi geneetiline uuring Ühendkuningriigis. II. Geneetilise nõustamise juhised. J Med Genet 1992; 29: 847-852.
- Evans DGR, Huson SM, Donnai D, Neary W, Blair V, Teare D, Newton V, Strachan T, Ramsden R, Harris R. 2. tüüpi neurofibromatoosi geneetiline uuring Ühendkuningriigis. I. Ema levimise mõju, mutatsiooni määr, sobivus ja kinnitamine ema raskusastmele. J Med Genet 1992; 29: 841-846.
- Evans DGR, Huson SM, Ponder M, Strachan T, Harding A. Spinaalne ja naha schwannomatosis on 2. tüüpi neurofibromatoosi variant. J Neurol Neurosurgi psühhiaatria 1997; 62: 361-366.
- Evans DGR, Ramsden R, Huson SM, Harris R, Lye R, King TT. 2. tüüpi neurofibromatoos: vajadus piirkondadevahelise hoolduse järele? J Laryngol Otol 199; 107: 401-406.
- Evans DGR, Wallace A, Trueman L, Wu CL, Ramsden RT, Strachan T. Mosaicism II tüüpi klassikalise neurofibromatoosi korral: sporaadilise haiguse levinud mehhanism tuumorile kalduvate sündroomide korral? Am J Hum Genet 1998; 63: 727-736.
- Evans G. R., C Watson, kuningas, A J Wallace ja M E Baser. Mitu meningioomi: geeni NF2 diferentsiaalne osalus lastel ja täiskasvanutel J. Med. Genet. 2005; 42; 45-48.
- Feiling A, Ward E. Akustilise kasvaja perekondlik vorm. BMJ 1920; 10: 496-497.
- Fucci MJ, Buchmani CA, Brackmann DE, Berliner KI. Kasvaja akustiline kasv: mõju ravivalikutele. Am J Otol 1999; 20: 495-499.
- Gareth R Evansa, M Sainiob, Michael E Baserc. 2. tüüpi neurofibromatoos. J Med Genet 2000; 37: 897-904
- Gottfried Oren N., Viskochil David H., Fults Daniel W., Couldwell William T. Neurofibroomide molekulaarne, geneetiline ja rakuline patogenees ja kirurgilised tagajärjed. Neurokirurgia 58: 1–16, 2006.
- Gronholm M. Sainio M. Zhao F. Heiska L. Vaheri A. Carpen O. Neurofibromatoosi 2 kasvaja supressori valgu merlini ja ERM valgu ezriini homotüüpiline ja heterotüüpiline interaktsioon. J Cell Sci, 1999; 112: 895-904.
- Gutmann DH. Giordano MJ. Fishback AS. Guha A. Merlini ekspressiooni kadumine sporaadiliste meningioomide, ependümoomide ja schwannoomide korral. Neurology 1997; 49: 267-270.
- Hartmann C, Sieberns J, Gehlhaar C, Simon M, Paulus W, von Deimling A. NF2 mutatsioonid sekretoorsetes ja muudes meningioomide haruldastes variantides. Aju patool. 2006 jaanuar; 16 (1): 15–9
- Hesselager G, Holland EC: Hiirte kasutamine ajukasvajate molekulaargeneetika dešifreerimiseks. Neurokirurgia 53: 685–695, 2003.
- Huynh DP, Mautner V, Baser ME, Stavrou D, Pulst SM. Schwannomini ja neurofibromiini immunohistokeemiline tuvastamine vestibulaarsetes schwannoomides, ependümoomides ja meningioomides. J Neuropathol Exp Neurol 1997; 56: 382-390.
- Kaiser-Kupfer MI, Freidlin V, Datiles MB, Eldridge R. Tagumise kapsliläätse hägususe seos kahepoolsete akustiliste neuroomidega 2. tüüpi neurofibromatoosiga patsientidel. Arch Ophthalmol 198; 107: 541-544.
- Kim DG, Paek SH, Chi JG, Chun YK, Han DH. Schwannoma ja meningioma komponentide segakasvaja NF-2 patsiendil. Acta Neurochir (Wien). 1997; 139 (11): 1061-4
- Kumar RA, Baser ME, Evans DGR, Wallace A, Mautner VF, Kluwe L, Rouleau G, Joe H, Friedman JM. Neurofibromatoosi 2 (NF2) kliiniliste ilmingute seos perekonnas. Am J Hum Genet 199; 65 (4. lisa): A155.
- Martuza RL, Ojemann RG. Kahepoolsed akustilised neuroomid: kliinilised aspektid, patogenees ja ravi. Neurokirurgia 1982; 10: 1–12.
- Mautner VF, Lindenau M, Baser ME, Hazim W, Tatagiba M, Haase W, Samii M, Wais R, Pulst SM. Seljaaju kasvajad II tüüpi neurofibromatoosiga patsientidel: MR-i pildistamise uuring sageduse, paljususe ja mitmekesisuse kohta (avaldatud erratum ilmub AJR 1996; 166: 1231). AJR 1995; 165: 951-955.
- Mautner VF, Lindenau M, Baser ME, Kluwe L, Gottschalk J. Naha kõrvalekalded neurofibromatoosis 2. Arch Dermatol 199; 133: 1539-1543.
- Mautner VF, Lindenau M, Baser ME, Tatagiba M, Haase W, Samii M, Wais R, Pulst SM. Neurofibromatoosi neuropildistamine ja kliiniline spekter 2. Neurokirurgia 199; 38: 880-885.
- Mautner VF, Tatagiba M, Guthoff R, Samii M, Pulst SM. Neurofibromatoos 2 laste vanuserühmas. Neurokirurgia 199; 33: 92-96.
- Riikliku tervishoiuinstituudi konsensuse arendamise konverentsi avaldus neurofibromatoosi kohta. Arch Neurol 1987; 45: 575-579.
- Otibi M, Rutka JT. I tüüpi neurofibromatoosi neurokirurgilised tagajärjed lastel. Neurosurgi fookus. 2006 15. jaanuar; 20 (1)
- Parry DM, Eldridge R, Kaiser-Kupfer MI, Bouzas EA, Pikus A, Patronas N. Neurofibromatoos 2 (NF2): 63 mõjutatud inimese kliinilised omadused ja kliinilised tõendid heterogeensuse kohta. Am J Med Genet 1994; 52: 450-451.
- Ragel BT, Jensen RL. Meningiomide molekulaargeneetika. Neurosurgi fookus. 2005 15. november; 19 (5)
- Ragge NK, Baser ME, Klein J, Nechiporuk A, Sainz J, Pulst SM, Riccardi VM. Silma kõrvalekalded neurofibromatoosis 2. Am J Ophthalmol 199; 120: 634-641.
- Ruttledge MH, Rouleau GA. II tüüpi neurofibromatoosi geeni roll närvisüsteemi kasvajate arengus. Neurosurgi fookus. 2005nov; 19 (5).
- Slattery WH, Brackmann DE, Hitselberger W. Kuulmise säilimine 2. tüüpi neurofibromatoosi korral. Am J Otol 199; 19: 638-643.
- Thomas PK, kuningas RHM, Chiang TR, Scaravilli F, Sharma AK, Downie AW. Neurofibromatoosne neuropaatia. Lihasnärv 1990; 13: 93-101.
- Tomita T, Radkowski MA, Gonzalez-Crussi F, Zaparackas Z, Flannery A. Mitu meningioomi lapsel. Surg Neurol. 1988 veebruar; 29 (2): 131-6.
- Tsukita S, Yonemura S. kortikaalse aktiini organiseerimine: õppetunnid ERM (ezrin / radixin / moesin) valkudest. J Biol Chemistry 1999; 274: 34507-34510.
- Turgut M, Palaoglu S, Ozcan OE. Neurofibromatoosi 2 neurokirurgilised aspektid: diagnoosimine ja juhtimine. Neurosurg Rev. 1998; 21 (1): 23-30.
- Zang KD. Tsütoloogilised ja tsütogeneetilised uuringud inimese meningioomil. Cancer Genet Cytogenet 1982; 6: 249-274.
- Zucman-Rossi J, Legoix P, Sarkissian HD, Cheret G, Sor F, Berardi A, Cazes L, Giraud S, Ollagnon E, Lenoir G, Thomas G. NF2 geen II tüüpi neurofibromatoosi korral. Hum Mol Genet 1998; 7: 2095-2101.